特集コンテンツ
次期改定から6月1日施行に後ろ倒し 中医協・総会が了承
2023/08/22 17:00
薬価改定の施行時期は従来通り4月1日
中央社会保険医療協議会・総会は8月2日、診療報酬改定の施行時期について、2024年度改定から6月1日に2ヶ月後ろ倒しする厚生労働省の提案を了承した。これに合わせて材料価格改定の施行時期も6月1日に変更するが、薬価改定は従来通り4月1日施行を維持する。
診療報酬改定DXの一環として実施するもので、これまで2~5月に集中していた診療報酬改定に伴うベンダや医療機関の業務負荷を平準化することが狙い。国はベンダに対し、診療報酬改定DXによって生じる負担軽減効果を運用保守経費等の軽減という形で医療機関等に確実に還元するよう求める方針を打ち出しており、24年度以降に推進していく関連施策を通じて医療機関等の間接コストの極小化を目指す。
24年度から改定は4月の薬価と6月の診療報酬本体の2段階施行に
今回の見直しで、24年度改定からは診療報酬本体(材料価格含む)と薬価の改定時期がずれることになる。薬価改定のみ4月改定を維持するのは、仮に施行時期を後ろ倒した場合、▽改定後の価格交渉に半年程度の期間が必要であり、毎年薬価改定が困難になる▽年4回の新薬の薬価収載などもあり、制度全体の見直しが必要になる-といった新たな問題が生じる点を考慮したため。
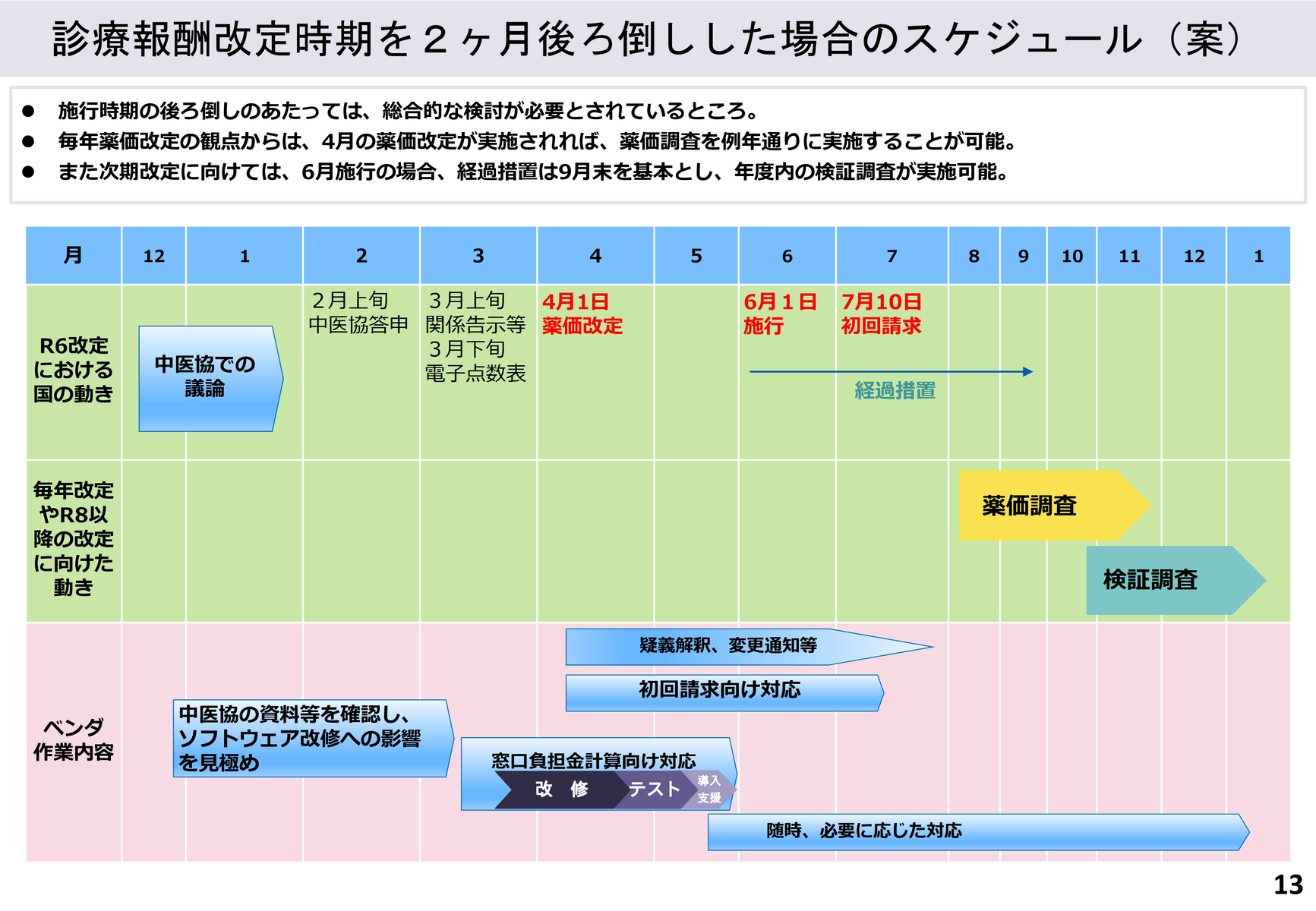
厚労省が総会に示したスケジュール案によると、診療報酬改定の中医協答申(2月上旬)、関係告示等の実施(3月上旬)、電子点数表の公表(3月下旬)の時期はこれまで通り。その後、4月1日に薬価改定を実施し、2ヶ月遅れる形で6月1日に診療報酬本体の改定を行う。疑義解釈や変更通知等の公表開始時期も従来の3月から4月に後ろ倒しする。
経過措置期間は9月末までを基本とする従来の取扱いを維持
また、経過措置期間は9月末までを基本とする現行の取扱いを踏襲し、改定の翌年に行う検証調査に支障が出ないように配慮する(資料1)。
総会では、診療側から現場の混乱を避けるため、医療機関や国民への周知徹底を図るよう求める声が相次いだ。長島公之委員(日本医師会常任理事)は、「施行時期の後ろ倒しで医療現場にどのようなメリットがあり、それが患者にどのように還元されるのかを明確化し、丁寧に周知していく取組が必要だ」と指摘。森昌平委員(日本薬剤師会副会長)は、改定を2回に分けることに伴う医療現場の負担や影響に加え、自己負担が2回変わることになる患者への影響に強い懸念を示した。その上で、「影響を丁寧に検証し、24年度以降の診療報酬改定DXの進め方はその結果を参考にして判断していくべきだ」と述べた。
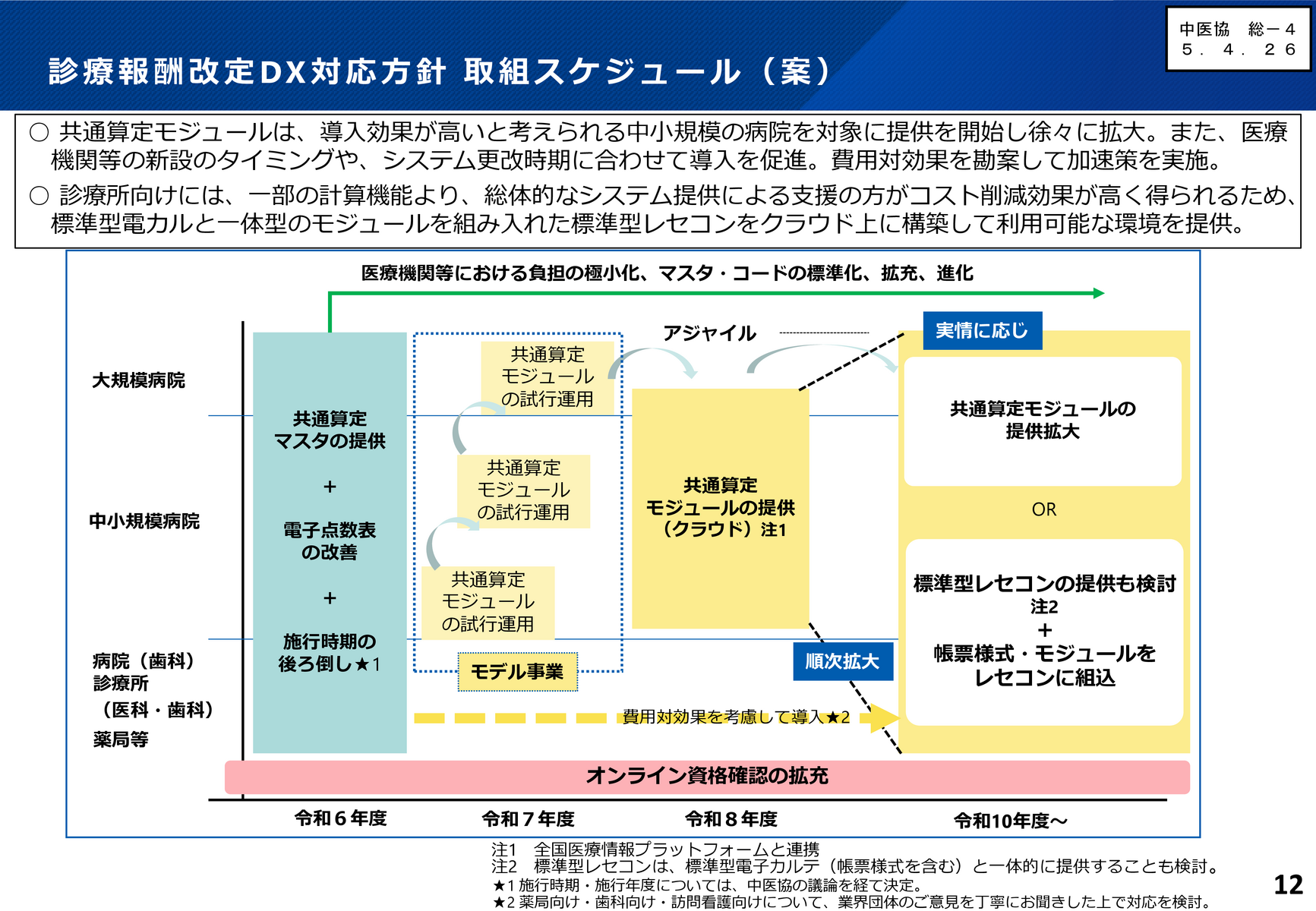
なお、政府の「医療DXの推進に関する工程表」は診療報酬改定DXについて、▽24年度に医療機関等の各システム間の共通言語となるマスタ及び、それを活用した電子点数表を改善・提供して共通コストを削減▽26年度には共通算定モジュール(診療報酬算定と患者の窓口負担計算を行う電子プログラム)を本格的に提供し、これらを実装した標準型レセコンや標準型電子カルテの提供を通じて医療機関等のシステムを抜本的に改革し、間接コストを極小化する-としている(資料2)。
後発医薬品産業の在るべき姿を明確化へ 厚労省・検討会が初会合
10月に中間とりまとめ、年内の最終とりまとめ目指す
厚生労働省の「後発医薬品の安定供給等の実現に向けた産業構造のあり方に関する検討会」は7月31日、初会合を開いた。少量多品目生産に代表される後発医薬品産業の構造的課題の解消策を探るとともに、産業としての在るべき姿やそれを具現化するための産業政策などについて幅広い視点で議論。年内を目途に最終とりまとめを行う。
検討会は、厚労省の「医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会」が今年6月にまとめた報告書の提言を受けて発足。今後、(1)後発医薬品産業の在るべき姿の明確化、(2)安定供給等の企業情報の可視化、(3)少量多品目構造の解消、(4)生産効率の向上、(5)その他、サプライチェーンの強靱化-の5項目について議論する。
厚労省が示したスケジュールによると、当面は論点(1)~(3)を審議し、10月頃にその結果を中間とりまとめとして公表。10月以降は論点(4)、(5)について集中審議し、12月には全ての論点に関する課題や解決策を盛り込んだ最終報告をとりまとめる(資料3)(資料4)。
この日の初会合では、論点(1)をテーマに意見を交換した。この中で厚労省は、後発医薬品産業の在るべき姿の明確化にあたって検討すべき課題として、▽達成時期(いつまでに在るべき姿に到達すべきか?)▽業界構造(どのような企業により構成されているべきか?)▽品目数(安定供給を確保するにあたって適当な品目数はどの程度か?)▽定量目標(在るべき姿への到達に係る進捗管理<PDCAサイクルのマネジメント>を行うためどのような目標<KPI>を設けるか?)▽その他、産業育成等の観点からの目標―の5項目を提示した。
検討会の審議状況は随時、中医協・薬価専門部会にも報告
薬価制度上の対応では、すでに中央社会保険医療協議会が2024年度薬価制度改革に向けた議論を始めている。国内企業の創薬力や国際競争力を高める観点から長期収載品(後発医薬品のある先発医薬品)の後発医薬品への置換えを加速し、長期収載品の収益に依存した現在の経営体質からの脱却を図ることが求められるが、その実現のためにも後発医薬品の安定供給の確保は必須。後発医薬品と長期収載品がテーマとなった8月2日の中医協・薬価専門部会では、厚労省が検討会の審議状況を随時報告する考えを明らかにしている。
(2023年8月8日時点の情報に基づき作成)
参考情報
厚生労働省 第551回中央社会保険医療協議会 総会
厚生労働省 第1回後発医薬品の安定供給等の実現に向けた産業構造のあり方に関する検討会
詳しくはこちら本資料の内容に関する一切の責任は株式会社日本経営に帰属します。また、この資料のいかなる部分も一切の権利は株式会社日本経営に所属しており、電子的又は機械的な方法を問わず、 いかなる目的であれ無断で複製又は転送等はできません。使用するデータ及び表現等の欠落、誤謬等につきましてはその責めを負いかねます。なお、内容につきましては、一般的な法律・税務上の取扱いを記載しており、具体的な対策の立案・実行は税理士・弁護士等の方々と十分ご相談の上、ご自身の責任においてご判断ください。